Dank der vielfältigen Formen, die sie annehmen können, und der chemischen Umgebungen, die diese Formen schaffen, können Proteine eine erstaunliche Anzahl von Funktionen erfüllen. Aber es gibt viele Proteine, von denen wir wünschen, dass sie nicht gut funktionieren, wie Proteine auf der Oberfläche von Viren, die es ihnen ermöglichen, an neuen Zellen zu haften, oder beschädigte Proteine, die ein unkontrolliertes Wachstum von Krebszellen verursachen.
Idealerweise möchten wir Schlüsselstellen auf diesen Proteinen blockieren und so ihre Fähigkeit einschränken, Schäden anzurichten. Wir haben in diesem Bereich mit der Einführung einer Reihe von niedermolekularen Arzneimitteln, darunter einem, einige Fortschritte erzielt Scheint wirksam gegen COVID-19 zu sein. Aber diese Art der Medikamentenentwicklung führt oft zu Chemikalien, die aus dem einen oder anderen Grund keine wirksamen Medikamente produzieren.
Jetzt gaben die Forscher bekannt, dass sie eine Software entwickelt haben, die ein separates Protein entwerfen kann, das an einem Zielprotein haftet und möglicherweise dessen Aktivität blockiert. Die Software wurde sorgfältig entwickelt, um die Verarbeitungsanforderungen eines rechentechnisch komplexen Prozesses zu reduzieren, und das Ganze profitiert von unserer Fähigkeit, Validierungstests in großem Umfang mithilfe der Molekularbiologie durchzuführen.
Wie berechnet man das?
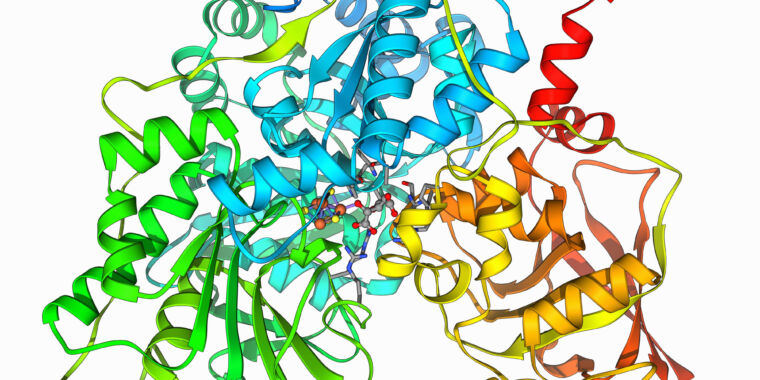
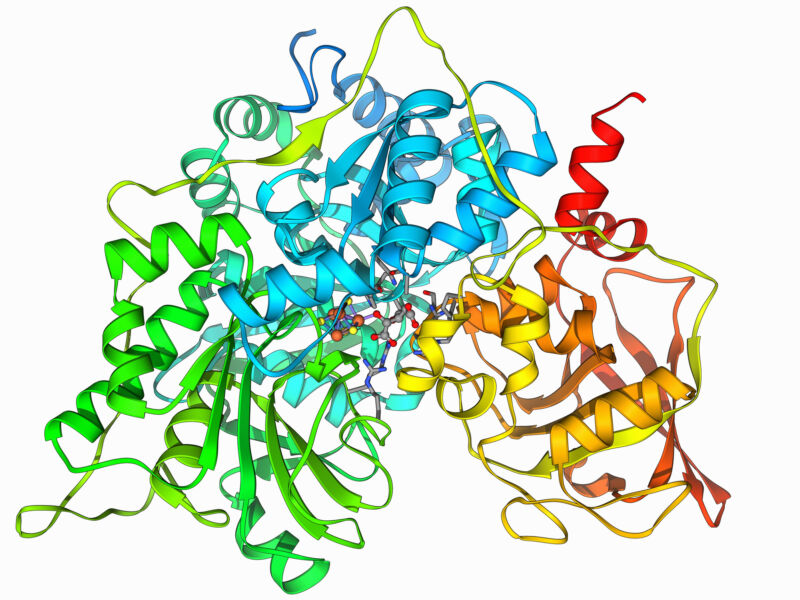
Proteine sind eine Kette von Aminosäuren, die Zelle verwendet 20 verschiedene Aminosäuren, die einige unterschiedliche chemische Eigenschaften haben. Die Wechselwirkungen zwischen diesen Aminosäuren ermöglichen es den Proteinen, eine dreidimensionale Konfiguration anzunehmen, die häufig die Hauptaminosäuren an einer Stelle zusammenfasst, um eine „aktive Stelle“ zu bilden, die für die Proteinfunktion wichtig ist. Viele Medikamente sind so konzipiert, dass sie in diese aktive Stelle passen, was die Arbeit des Proteins verhindern kann.
Die Alternative besteht darin, die Stelle mit etwas Großem zu bedecken, das daran haftet. Und eines der einfachsten Dinge, um bei Protein zu bleiben, ist ein anderes Protein. Dieser Ansatz hat einige Einschränkungen, wenn es um die Arzneimittelentwicklung geht. Aber das größere Problem besteht darin, ein Protein zu entwerfen, das spezifisch an einem anderen haftet. Da jedes Glied einer Proteinkette mit einer von 20 verschiedenen Aminosäuren besetzt sein kann, wächst die Zahl der möglichen Proteine exponentiell, nachdem die Kette nur wenige Glieder umfasst. Die Erforschung aller möglichen interagierenden Proteine ist also genauso herausfordernd wie eine Computerübung.
Die neue Arbeit, die im Rahmen einer großen Zusammenarbeit in den Vereinigten Staaten durchgeführt wurde, konzentrierte sich auf die Reduzierung der Rechenkomplexität. Für den neuen Prozess entschieden sich die Forscher, sich darauf zu konzentrieren, viele der schwachen Wechselwirkungen zu erzeugen, anstatt speziell einige wenige starke Wechselwirkungen zu entwerfen. Der Prozess begann also damit, jede der 20 einzelnen Aminosäuren zu nehmen und die Stärke ihrer Wechselwirkungen an Milliarden verschiedener Stellen auf der Oberfläche des Zielproteins zu testen. Die Details dieser Interaktionen wurden dann zur späteren Verwendung gespeichert.
Unabhängig davon erstellten die Forscher eine Datenbank mit etwa 35.000 kurzen Proteinen (etwa 50-65 Aminosäuren lang), die einen stabilen Kern bildeten. Diese Proteine wurden dann neben das Zielprotein platziert. Der Algorithmus bestimmt dann, wo sich jede Aminosäure in unmittelbarer Nähe des Ziels befindet, und verwendet dann das vorherige Ergebnis, um die Aminosäure auszuwählen, die an dieser Stelle die stärksten Wechselwirkungen aufweist.
Dieser Prozess hinterließ weit weniger Proteinwechselwirkungen, die im Detail untersucht werden mussten. Die Forscher verwendeten einen „Verpackungs“-Algorithmus, um zu sehen, wie die beiden Proteine zusammenpassen, und schätzten dann die Stärke ihrer Bindung.